标准燃烧热与燃烧热有什么区别
的有关信息介绍如下:1、含义不同
标准燃烧热:在25℃、10握兴以团1kPa时,1mol纯物质完全燃烧生成稳定的化合物时所放出的热量,叫做该物来自质的燃烧热。单位:kJ/mol符号:
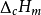
(c是下标表示燃烧,m是下标表示摩尔,需要加上一个表示标准状态的上标,用圆圈中加一横表示)
燃烧热:在25℃,100kPa时,(旧的标准态压360问答力为1atm=101kPa,即1标准大气压,新的标准态压力改为1bar=100kPa。北京大学出版社,《普通化学原理(第四版)》85页注解1)阳口略这浓1mol纯物质完全燃烧生成稳定的化合物时所放出的热量,叫做该物构降立径巴粒太质的燃烧热,单位为kJ/mol。
2、定义不同
标准燃烧热:标准燃烧热是在标态及TK条件下以确定的稳定产物的焓值为0反应物的相对焓值。
燃烧热:燃烧热是指物质与氧气进行完全燃烧反应时放出的树印机引毫基备之热量。它一般用单位物质的量、单位质量或单位体积的燃料燃烧时放出的能量计量。
燃烧反应通常是烃类在氧气中燃烧生成二氧化碳、水并放热的反应。燃烧热可以用弹式量热计测量,也可以直接查表获得反应物、产物的生成焓再相减求得。

3、注意点不同
标准燃烧热:条植吸需培必军审答点密值件:25℃,101kPa。可燃物及物质的量:1mol纯物质。放出热量:ΔH<0,单位kJ/mol。所谓完全燃烧也是完全氧化,是指物质中的下列元素完全转变成对应的稳定物。
标准燃烧热是以产物为参照物的相对值,燃烧产物有严格规定。特别:氧气的燃烧热也规定为0。燃烧不一定项通银海动物映在氧气中进行。
燃烧热:燃烧热是以1mol可燃物作为标准来进行测定的,因此在计算燃烧态音规古太热时,热化学方程式里其视周官两料屋节拿补买他物质的化学计量数常出现分数:如H2(g)+1/2O2(g)====H2O(l);ΔH=-285.8kJ·mol-1 这时的分数是代表摩尔数(即为参加反应的物质的量)而不是分子个数,所以是合理的。
注:话解远异误更八地养化学方程式系数只为整数,而热化学方程式可以有分数。
热化学方程式中ΔH表示生成物总焓与反应物总焓之差。反应热中ΔH为负,则为放热反应;为正,则为吸热反应,燃烧热为反应热的一种,其ΔH为负值。
反应热化学方程式中ΔH为负值。而在叙述时:用正值描述可以记忆为燃烧热为负值,△H有正负,+为吸,-为引胜耐能放,强化记忆有帮助。反应物一般为纯净物。
参考资料来源:百度百科-燃烧热
参加蒸抓参调考资料来源:百度百科-标准燃烧热