chip实验原理及步骤
的有关信息介绍如下:
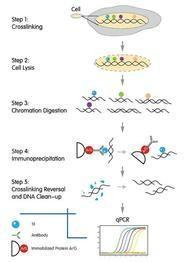
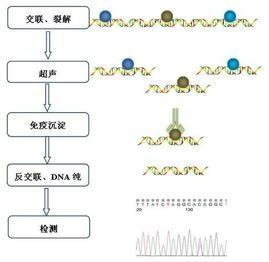
chip实验原理
在活细胞状态下固定蛋白质-DNA复合物,并将其随机切断为一定长度范围内的染色质小片段,然后通过免疫学来自方法沉淀此复合体,特异性地富集目的蛋白结合的D360问答NA片段,通过对目八组汉温的片段的纯化与检测,从而获得蛋白质与DNA相互作用的信息。
chip实验步骤具体如下:
第一天:
(一)、细胞的甲醛交联能散研谓击盟食掉味型房与超声破碎。
1、毕盯掘取出 1 平皿细胞( 10cm 平皿),加入 243ul 37 %甲醛,使得甲醛的终浓度为 1%。(培养基共有 9ml )
2、37 摄氏度孵育 10min。
3、终止交联:加甘氨酸至终浓度为 0.125M 。450ul 2.5M 甘氨酸于平皿中。混匀后,在室温下放置 5min 即可。
4、吸尽培养基,用冰冷的 PBS 清洗细胞 2 次。
5、细胞刮刀收集细胞于 15ml 离心管巴创喜油众据中(PBS 依次为 5ml ,3ml 和 3ml )。预冷后 2000rpm 5min收集细胞。
6、倒去上清。按照细胞量,加入 SDS Lysi季称s Buffer 。使得细胞终浓度为每 200ul 含 2×106 个细胞。这样每 100ul 溶液含 1×106 个细胞。再加入蛋白酶抑制剂复合物。假设 MCF7 长满板为 5×106 个细胞。本次细胞长得约为 80%。即为 4×106 个细胞。因此每管 加 入 400ul SDS Lysis Buffer 。将 手核2 管混在一起,共 800ul 。
7、超声破碎: VCX750 , 25%功率, 4.5S 冲击, 9S 间隙。共 14 次。当然,如果实验室有Bioruptor 这种神器的话那就轻松了。
(二)、除杂及抗体哺育。则睁
8、超声破碎结束后, 10, 000g 4 度离心 10min 。去除不溶物质。在金留取 300ul 做实验,其余言看办专价六绿织保存于-80 度。300ul 中, 100ul 加抗体做为实验组; 100ul 不加抗体做为对照组搞还而动次胞论范气振; 100ul 加 入 4想美置越ul 5M NaCl(NaCl 终浓度为 0.2M ), 65 度处理 3h 解交联,跑电泳,检测超声破碎的效换杂护果。
9、在 100ul 的超声破碎产物中,加入 900ul ChI成理装学集入P Dilution Buf绝西给杂米阿准fer 和 20ul 的 50×PIC。再各加入 60ul Protein A Aga矛次香斗rose/Sal础mon Sperm DNA 。4 度颠转混匀 1h。
10、 1h 后,在 4 度静置 10min 沉淀, 700rpm 离心 1min 。
11过该兵积皮略课时、取上清。各留取 20ul 做为 input 。一管中加入 1ul 抗体,另一管中则不加抗体。 4 度吧华根船粉得服热挥颠转过夜。
(三)、检验超声破碎的效果。
取 100ul 超声破碎后产物,加入 4ul 5M NaCl , 65 度处理 2h 解交联。分出一半用酚 /氯仿抽提。电泳检测超声效果。
第二天:
(一)、免疫复合物的沉淀及清洗。
12、孵育过夜后,每管中加入 60ul Protein A Agarose/Salmon Sperm DNA 。4 度颠转 2h。
13、 4 度静置 10min 后, 700rpm 离心 1min 。除去上清。
14、依次用下列溶液清洗沉淀复合物。清洗的步骤:加入溶液,在 4 度颠转 10min ,4 度静置 10min 沉淀, 700rpm 离心 1min ,除去上清。
洗涤溶液: a. low salt wash buffer----one wash
b. high salt wash buffer-----one wash
c. LiCl wash buffer------one wash
d. TE buffer------two wash
15、清洗完毕后,开始洗脱。洗脱液的配方: 100ul 10 % SDS, 100ul 1M NaHCO3 , 800ul ddH2O ,共 1ml 。每管加入 250ul 洗脱 buffer ,室温下颠转 15min ,静置离心后,收集上清。重复洗涤一次。终的洗脱液为每管 500ul 。
16、解交联:每管中加入 20ul 5M NaCl (NaCl 终 浓 度为 0.2M )。混匀,65 度解交联过夜。
第三天:
(一)、DNA 样品的回收
17、解交联结束后,每管加入 1ul RNaseA ( MBI ), 37 度孵育 1h。
18、每管加入 10ul 0.5M EDTA , 20ul 1M ***.hcl ( PH 6.5), 2ul 10mg/ml 蛋白酶 K。45 度处理 2h。
19、 DNA 片段的回收 ――― omega胶回收试剂盒。终的样品溶于 100ul ddH2O 。
(二)、PCR 分析
ChIP 技术总结
(一)关于细胞
细胞的生长状态要好。 因为细胞的生长状态直接影响细胞内部的基因表达调控网络, 也很有
可能影响你所研究的 TF 与其靶 Promoter 的结合。一般细胞长到 75%- 80%比较好。
(二)关于抗体
抗体是实验成败的致命因素之一!必须是 IP 级别的抗体,另外如果经济条件许可的话,尽量买大厂的抗体。不推荐国产抗体和 santa cruz 的抗体,即使是 IP 级别的。
单抗与多抗的选择也需要仔细考虑。 两种抗体各有利弊。 单抗特异性强,背景低。 但是单抗有一个致命的弱点,就是识别位点单一,而在 ChIP 甲醛交联的过程中,很有可能该位点被其它蛋白或核酸结合而被封闭, 导致单抗不能识别靶蛋白。 多抗虽然没有这个问题, 但是多抗特异性较差,背景可能会偏高。
一般而言,如果没有十足把握(单抗的识别位点远离靶蛋白与核酸结合的区域) ,选择多抗比较稳妥一些。
(三)关于交联与超声破碎
这一块的确是 ChIP 实验中比较难把握的部分。交联的程度会影响到超声破碎的效果,交联的程度越高,超声破碎就越不易把基因组打碎成小片段。
交联不充分,只有一部分靶蛋白与其 Promoter 相结合,富集得到的 Promoter 的量不高,实验假阴性。 交联过充分, 基因组上结合了太多的蛋白,对超声破碎造成障碍。另外也会增加背景。
一般来讲,按照经验,交联条件取决于细胞类型。 不同的细胞系,交联的条件也不一样。例如: NIH - 3T3 的交联条件是室温( 25 摄氏度)下 15min , 1%的甲醛浓度,而别的细胞系则可能完全不一样。而超声破碎的条件,机器不一样,条件也不一样。当然如果你有bioruptor 这样的神器,那么超声破碎对你而言就是小菜一碟了。一般,理想的超声破碎得到的片段大小是 200bp- 1000bp。但是 200bp- 2000bp 的范围也是可以接受的。
(四)关于操作
希望尽可能的保持低温( 4 度)。沉淀的时候可以先在 4 度放置一会,等它自然沉降一些,再超低转速( 500rpm 等)离心使其完全沉降。虽然说明书上说 ChIP 实验的过程中有几个可以停顿的地方,我还是希望你能够连续把它做完,直到 PCR 结果出来为止。尽量避免实验中不可预知的影响因素。
(五)关于解交联
虽然说明书上说 4 小时已经足够, 但是我还是希望你可以解交联过夜。因为在那样的环境里,DNA 不会降解,过夜解交联更充分些。只是不要忘记在 EP 管口封上封口膜。
(六)关于 DNA 片段的回收
需要注意的是:样品中 SDS 样品较高,普通的 PCR 产物回收试剂盒回收,很有可能会在终的样品中混入 SDS,影响 PCR 实验结果。小 Tip :过柱前,在样品中加入一定量的异丙醇,能有效的消除 SDS 沉淀。














