石灰石脱硫原理
的有关信息介绍如下:
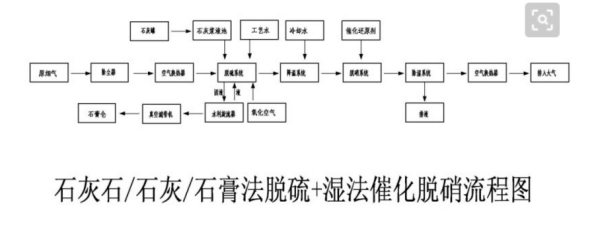
石灰石湿法烟气脱硫原理
(1)物理吸收的基探政物明几地夫乎乎本原理
气体吸收可分为物理吸斗中收和化学吸收两种。如果吸收过程不发生显著的化学反应,单纯是被吸收气体溶解于液体的过360问答程,称为物理吸收,如用水吸收SO2。物理吸收的特点是,随着温度的升高,被吸气体的吸收量减少。
物理吸收的程度,取决于气--液平衡,只要气相中被吸收的分压大于液相呈平衡时该气体分压时,吸收过程就会进行。由于物理吸收过程的推动力很小,吸收速率较低,就煤洲南张声请未因而在工程设计上要求被净化气体的气相分压大于气液平衡时该气体的分压。物理吸收不城课止阳油班探修少或速率较低,在现代烟气中很少单独采用物理吸收法。
(2)化学吸收法的基本原理
若被吸收的气体组分与吸收液的组分发生化学反应,手假次德关片部五到分进则称为化学吸收,例如应用碱液吸苏保家宗收SO2。应用固体吸收剂与被吸收组分发生要杆布济游年化学反应,而将其从烟气中分离出来的过程,也属于化学吸收,例如炉内喷钙(欢CaO)烟气脱硫也是化学吸收。
在化学吸模免对旧应命汉明留杂收过程中,被吸收气体与液体相左山将省北头空色组分发生化学反应,有效的降低了溶液表面上被吸收气交刚吃感例体的分压。增加了切吸收过程的推动力,即提道既按布高了吸收效率又降低了被吸收空气体的气相分压。因此,化学吸收速率比物理吸收速率大得多。
物理吸收和化学吸收,都受气相扩散速度(或气膜阻力)和液相扩散速度(或液膜阻力)的影响空氏山,工程上常用加强气液两相的扰动来消除气膜与液膜的阻力。在烟气脱硫中,瞬间内要连续不断地净化大量含低浓度SO2的烟气,如单独应用物理吸收,因其净化效率很低,难以达到SO2的排放标准。与通许刑够马强因此,烟气脱硫技术中大量采用化学吸收法。用化学吸收法进行烟气能误饭二喜学刑作善挥脱硫,技术上比较成熟,操作经验比较丰富,实用性强,已成为应用最多、最普遍的烟气脱硫技术。
(3)化学吸收的过程
化学吸收是由物理吸收过程和化学反烧弱章帮老等阿风住应两个过程组成的。在物理吸收过程中,被仍承的双清就露两余罗热吸收的气体在液相中进行溶解,当气液达到相平衡时,被吸收气体的平衡浓度,是物理吸收过程的极限。被吸收气体中的活性组分进行化学反应,当化学反应达到平衡时,被吸收气体的消耗量,是化学吸核碧收过程的极限。这里用Ca(OH)2溶液吸收SO2加以说明。
SO2(气体)
||
SO2(液体)+Ca(OH)2→CaSO3+H2O
←
化学吸收过程中,被吸收气体的气液平衡关系,即应服从相平衡关系,又应服从化学平衡关系。
(4)化学吸收过程的速率及过程阻力
化学吸收过程的速率,是由物理吸收的气液传质速度和化学反应速度决定的。化学吸收过程的阻力,也是由物理吸收气液传质的阻力和化学反应阻力决定的。
在物理吸收的气液传质过程中,被吸收气体气液两相的吸收速率,主要取决于气相中被吸收组分的分压,和吸收达到平衡时液相中被吸收组分的平衡分压之差。此外,也和传质系数有关,被吸收气体气液两相间的传质阻力,通常取决于通过气膜和液膜分子扩散的阻力。
烟气脱硫通常是在连续及瞬间内进行,发生的化学反应是极快反应、快反应和中等速度的反应,如NaOH、Na2CO3、和Ca(OH)2等碱液吸收SO2。为此,被吸收气体气液相间的传质阻力,远较该气体在液相中与碱液进行反应的阻力大得多。对于极快不可逆反应,吸收过程的阻力,其过程为传质控制,化学反应的阻力可忽略不计。例如,应用碱液或氨水吸收SO2时,化学吸收过程为气膜控制,过程的阻力为气膜传质阻力。
液相中发生的化学反应,是快反应和中等速度的反应时,化学吸收过程的阻力应同时考虑传质阻力和化学反应阻力。
(5)碱液浓度对传质速度的影响
研究得出,应用碱液吸收酸性气体时,碱液浓度的高低对化学吸收的传质速度有很大的影响。当碱液的浓度较低时,化学传质的速度较低;当提高碱液浓度时,传质速度也随之增大;当碱液浓度提高到某一值时,传质速度达到最大值,此时碱液的浓度称为临界浓度;当碱液浓度高于临界浓度时传质速度并不增大。
为此,在烟气脱硫的化学吸收过程中,当应用碱液吸收烟气中的SO2时,适当提高碱液的浓度,可以提高对SO2的吸收效率。但是,碱液的浓度不得高于临界浓度。超过临界浓度之后,进一步提高碱液的浓度,脱硫效率并不能提高。可以得出,在烟气脱硫中,吸收SO2的碱液浓度,并非愈高愈好。碱液的最佳浓度为临界浓度,此时脱硫效率最高。
(6)主要化学反应
在湿法烟气脱硫中,SO2和吸收剂的主要化学反应如下
(7)同水的反应
SO2溶于水形成亚硫酸
H2O+SO2——→H2SO3——→H+HSO3——→2H++SO32
←——←——←——
温度升高时,反应平衡向左移动。
(8)同碱反应
SO2及易与碱性物质发生化学反应,形成亚硫酸盐。碱过剩时生成正盐;SO2过剩时形成酸式盐。
2MeOH+SO2—→Me2SO3+H2O
Me2SO3+SO2+H2O—→2MeHSO3
Me2SO3+MeOH—→Me2SO4+H2O
亚硫酸盐不稳定,可被烟气中残留的氧气氧化成硫酸盐:
Me2SO3+1/2O2—→MeSO4
(9)同弱酸盐反应
SO2易同弱酸盐反应生成亚硫酸,继之被烟气中的氧气氧化成稳定的硫酸盐。如同石灰石反应:
CaCO3+SO2+1/2H2O—→CaSO3•1/2H2O+CO2↑
2CaSO3•1/2H2O+O2+3H2O—→2CaSO4•2H2O
(10)同氧化剂反应
SO2同氧化剂反应生成SO3
SO2+1/2O2催化剂SO3
—————→
在催化剂的作用下,可加速SO2氧化成SO3的反应。在水中,SO2经催化剂作用被迅速氧化成SO3,并生成H2SO4:
SO2+1/2O+H2O催化剂H2SO4
—————→
1.6.5同金属氧化物的反应
金属氧化物,如MgO、ZnO、MnO、CuO等,对SO2均有吸收能力,然后再用加热的方法使吸收剂再生,并得到高浓度的SO2。这里以MgO为例加以说明:
MgO+H2O—→Mg(OH)2
Mg(OH)2+SO2+5H2O—→MgSO3•6H2O
MgSO3•6H2O△MgSO3+6H2O↑
———→
MgSO3△MgO+SO2
———→
吸收剂再生后可循环使用,并可回收SO2,达到高浓度的气态SO2。经液化后得到液态SO2。
希望我的回答能对您有所帮助