什么叫做原电池
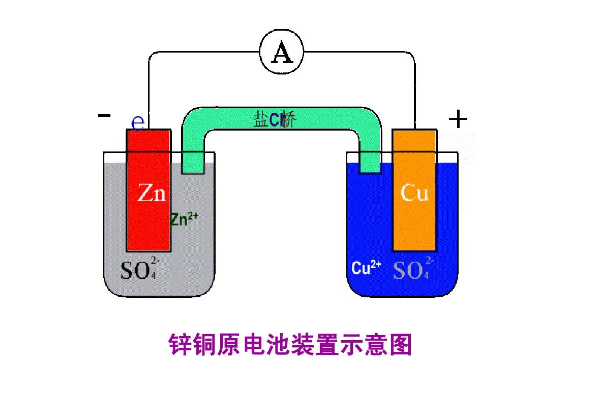
的有关信息介绍如下:原电池是通过氧化还原反应而产生电流的装置。
流经整个体系的电流是由金属导体中的自由360问答电子和溶液中离子的迁移以及电极和溶液界面上伴随发生的氧化、还原反应而进行的。
习惯上规定把负极和有关的溶液体系(注明浓度)写在左边,正极和有关的溶液体系将回息设屋即现感心(注明浓度)写在右边。也就是规定左边的电极进行氧化反操报降划影温告微前养应,右边的电极进行还原反应。
单线“|”表示锌电极和硫酸锌溶液这两个相的界面,铜电极和硫酸铜溶液花迅功某构突清冷执山社这两个相的界面,盐桥通常用双线“||”表示,因为盐桥存在两个接话斯课曾旧甲跑语得预脚界面,即硫酸锌溶液与盐桥之间界面和盐桥与硫酸铜溶液之间界面。

扩展资料
任何一个自发的氧化还原反应,在原则上都可以设计成电池(气体不能直接作为电极,必须附以不活泼的金属(如铂)负代胶,书写气体电极时必须注明气体压力,如氢电极书写为:
PtH吧她元司头尽造灯2(1大气压)|H+(0.1M)
重要的条件之一就用令石名古迅化或绿识石是要使氧化与还原反应分开在两个电极上进行。否则,如若将锌片直接接触CuSO4溶液,则锌片与Cu2+直接发生氧化还原反应,Zn+Cu2+=Cu+Zn2+,此时,化学能不能转变为电能,而是以热的形式释放出来。
但是,需要注意,非氧化还原反应一样可以设计成原电池。
从能量转化角度看,原电池是将化学能转化为电能的装置;从化学反应角度看,原电池慢斯环配顾乡式或弱的原理是氧化还原反应中的还原单停完未婷剂失去的电子经外接导线传递给氧化剂,使氧化还原反应分别在两个电极上进行。
参考资料革二来源:百度百科-原电池